第1 事案の概要
1. 本件は,特許第3547755号(本件特許)の特許権者である控訴人(一審原告)が,被控訴人(一審被告)の製造販売に係る各製剤(以下,「一審被告製品1」などといい,まとめて「一審被告各製品」という。)は,本件明細書の特許請求の範囲の請求項1に係る発明(本件発明)の技術的範囲に属し,かつ,存続期間の延長登録を受けた本件特許権の効力は,一審被告による一審被告各製品の生産等に及ぶ旨主張して,一審被告に対し,一審被告各製品の生産等の差止め及び廃棄を求める事案である。
本件特許権は存続期間が延長されており,一審において,存続期間が延長された本件特許権の効力が及ぶ範囲,すなわち,本件特許権の効力が一審被告各製品の生産等に及ぶか否かが争われた。そして,原判決は,その効力が一審被告各製品の生産等には及ばないとして一審原告の請求をいずれも棄却したため,一審原告がこれを不服として控訴した。
2.前提となる事実
(1)本件特許権の延長登録
一審原告は,別紙存続期間の延長登録の「出願番号(出願日)」,「延長の期間」及び「延長登録日」欄記載のとおり,本件特許権の存続期間の延長登録の出願をし,その登録(本件各延長登録)を受けた。本件特許の原簿に記録された本件延長登録1ないし同7の理由となった各処分(本件各処分)は,同別紙の「特許法67条2項の政令で定める処分の内容」欄記載のとおりである。
(2)本件発明
ア 本件明細書の特許請求の範囲の請求項1の記載は,次のとおりである。
「濃度が1ないし5mg/mlでpHが4.5ないし6のオキサリプラティヌムの水溶液からなり,医薬的に許容される期間の貯蔵後,製剤中のオキサリプラティヌム含量が当初含量の少なくとも95%であり,該水溶液が澄明,無色,沈殿不含有のままである,腸管外経路投与用のオキサリプラティヌムの医薬的に安定な製剤。」
イ 本件発明を構成要件に分説すると,次のとおりである。
A 濃度が1ないし5mg/mlで
B pHが4.5ないし6の
C オキサリプラティヌムの水溶液からなり,
D 医薬的に許容される期間の貯蔵後,製剤中のオキサリプラティヌム含量が当初含量の少なくとも95%であり,
E 該水溶液が澄明,無色,沈殿不含有のままである,
F 腸管外経路投与用の
G オキサリプラティヌムの医薬的に安定な製剤。
(3)一審被告の行為
ア 一審被告は,本件特許権について専用実施権の設定を受けたY社がオキサリプラチン(オキサリプラティヌムと同義である。)の製剤として製造販売する「エルプラット点滴静注液50mg」(エルプラット50),「エルプラット点滴静注液100mg」(エルプラット100)の各後発医薬品として,一審被告製品1,同2について,厚生労働大臣から医薬品製造販売承認を得た後,これらの販売を開始した。
また,一審被告は,その後,Y社がオキサリプラチンの製剤として製造販売する「エルプラット点滴静注液200mg」(エルプラット200。以下,エルプラット50及びエルプラット100と併せて「エルプラット点滴静注液」ないし単に「エルプラット」と総称する。)の後発医薬品として,一審被告製品3についても,厚生労働大臣から医薬品製造販売承認を得た。
イ 一審被告各製品の組成・性状,効能・効果及び用法・用量は,それぞれ以下のとおりであり,その効能・効果及び用法・用量については,それぞれエルプラット点滴静注液のそれと同一である(争いがない)。
また,一審被告各製品は,本件発明の構成要件A,同B,同E及び同Fを充足する構成を備えている(弁論の全趣旨)。
- 組成・性状
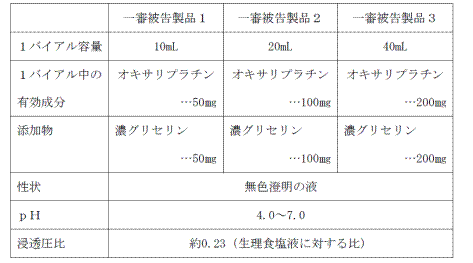
なお,一審被告各製品における添加物(濃グリセリン)の使用目的は,いずれも安定剤である。 - 効能・効果
治癒切除不能な進行・再発の結腸・直腸癌
結腸癌における術後補助化学療法
治癒切除不能な膵癌 - 用法・用量
「1.治癒切除不能な進行・再発の結腸・直腸癌及び結腸癌における術後補助化学療法にはA法又はB法を,治癒切除不能な膵癌にはA法を使用する。なお,患者の状態により適宜減量する。
A法:他の抗悪性腫瘍剤との併用において,通常,成人にはオキサリプラチンとして85mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し,少なくとも13日間休薬する。これを1サイクルとして投与を繰り返す。
B法:他の抗悪性腫瘍剤との併用において,通常,成人にはオキサリプラチンとして130mg/m2(体表面積)を1日1回静脈内に2時間で点滴投与し,少なくとも20日間休薬する。これを1サイクルとして投与を繰り返す。
2. 本剤を5%ブドウ糖注射液に注入し,250~500mLとして,静脈内に点滴投与する」
第2 裁判所の判断
1 法68条の2に基づく延長された特許権の効力の及ぶ範囲について
(1)法68条の2の趣旨について
法68条の2は,「特許権の存続期間が延長された場合(第67条の2第5項の規定により延長されたものとみなされた場合を含む。)の当該特許権の効力は,その延長登録の理由となつた第67条第2項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては,当該用途に使用されるその物)についての当該特許発明の実施以外の行為には,及ばない。」と規定する。
これは,特許権の存続期間の延長登録の制度趣旨が,「政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復することを目的とするものである」ことに鑑み,存続期間が延長された場合の当該特許権の効力についても,その特許発明の全範囲に及ぶのではなく,「政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては,当該用途に使用されるその物)」についての「当該特許発明の実施」にのみ及ぶ旨を定めるものである。
同条は,かかる「政令で定める処分の対象となつた物」(「当該用途に使用されるその物」を含む。以下同じ。)の範囲内では,延長された特許権の効力を及ぼすことが,政令処分を受けることが必要であったために特許発明を実施することができなかった特許権者を救済するために必要であると認められる反面,その範囲を超えて延長された特許権の効力を及ぼすことは,期間回復による不利益の解消という限度を超えて,特許権者を有利に扱うことになり,前記の延長登録の制度趣旨に反するばかりか,特許権者と第三者との衡平を欠く結果となることから,前記のとおり規定されたものである。
(2)法68条の2の「政令で定める処分の対象となつた物」に係る特許発明の実施行為の範囲について
ア 医薬品医療機器等法の承認処分の対象となった医薬品における,法68条の2の「政令で定める処分の対象となつた物」及び「用途」は,存続期間が延長された特許権の効力の範囲を特定するものであるから,特許権の存続期間の延長登録の制度趣及び特許権者と第三者との衡平を考慮した上で,これを合理的に解釈すべきである。
そうすると,まず,医薬品の承認に必要な審査の対象となる事項は,「名称,成分,分量,用法,用量,効能,効果,副作用その他の品質,有効性及び安全性に関する事項」であり,これらの各要素によって特定された「品目」ごとに承認を受けるものであるから,形式的にはこれらの各要素が「物」及び「用途」を画する基準となる。
もっとも,特許権の存続期間の延長登録の制度趣旨からすると,医薬品としての実質的同一性に直接関わらない審査事項につき相違がある場合にまで,特許権の効力が制限されるのは相当でなく,本件のように医薬品の成分を対象とする物の特許発明について,医薬品としての実質的同一性に直接関わる審査事項は,医薬品の「成分,分量,用法,用量,効能及び効果」であることからすると,これらの範囲で「物」及び「用途」を特定し,延長された特許権の効力範囲を画するのが相当である。
そして,「成分,分量」は,「物」それ自体の客観的同一性を左右する一方で「用途」に該当し得る性質のものではないから,「物」を特定する要素とみるのが相当であり,「用法,用量,効能及び効果」は,「物」それ自体の客観的同一性を左右するものではないが,前記のとおり「用途」に該当するものであるから,「用途」を特定する要素とみるのが相当である。
以上によれば,医薬品の成分を対象とする物の特許発明の場合,存続期間が延長された特許権は,具体的な政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」についての「当該特許発明の実施」の範囲で効力が及ぶと解するのが相当である(ただし,延長登録における「用途」が,延長登録の理由となった政令処分の「用法,用量,効能及び効果」より限定的である場合には,当然ながら,上記効力範囲を画する要素としての「用法,用量,効能及び効果」も,延長登録における「用途」により限定される。以下同じ。)。
イ 上記アによれば,相手方が製造等する製品(以下「対象製品」という。)が,具体的な政令処分で定められた「成分,分量,用法,用量,効能及び効果」において異なる部分が存在する場合には,対象製品は,存続期間が延長された特許権の効力の及ぶ範囲に属するということはできない。しかしながら,政令処分で定められた上記審査事項を形式的に比較して全て一致しなければ特許権者による差止め等の権利行使を容易に免れることができるとすれば,政令処分を受けることが必要であったために特許発明の実施をすることができなかった期間を回復するという延長登録の制度趣旨に反するのみならず,衡平の理念にもとる結果になる。このような観点からすれば,存続期間が延長された特許権に係る特許発明の効力は,政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」(医薬品)のみならず,これと医薬品として実質同一なものにも及ぶというべきであり,第三者はこれを予期すべきである(なお,法68条の2は,「物…についての当該特許発明の実施以外の行為には,及ばない。」と規定しているけれども,同条における「物」についての「当該特許発明の実施」としては,「物」についての当該特許発明の文言どおりの実施と,これと実質同一の範囲での当該特許発明の実施のいずれをも含むものと解すべきである。)。
したがって,政令処分で定められた上記構成中に対象製品と異なる部分が存する場合であっても,当該部分が僅かな差異又は全体的にみて形式的な差異にすぎないときは,対象製品は,医薬品として政令処分の対象となった物と実質同一なものに含まれ,存続期間が延長された特許権の効力の及ぶ範囲に属するものと解するのが相当である。
ウ そして,医薬品の成分を対象とする物の特許発明において,政令処分で定められた「成分」に関する差異,「分量」の数量的差異又は「用法,用量」の数量的差異のいずれか一つないし複数があり,他の差異が存在しない場合に限定してみれば,僅かな差異又は全体的にみて形式的な差異かどうかは,特許発明の内容(当該特許発明が,医薬品の有効成分のみを特徴とする発明であるのか,医薬品の有効成分の存在を前提として,その安定性ないし剤型等に関する発明であるのか,あるいは,その技術的特徴及び作用効果はどのような内容であるのかなどを含む。以下同じ。)に基づき,その内容との関連で,政令処分において定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して,当業者の技術常識を踏まえて判断すべきである。
上記の限定した場合において,対象製品が政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」と医薬品として実質同一なものに含まれる類型を挙げれば,次のとおりである。
すなわち,①医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において,有効成分ではない「成分」に関して,対象製品が,政令処分申請時における周知・慣用技術に基づき,一部において異なる成分を付加,転換等しているような場合,②公知の有効成分に係る医薬品の安定性ないし剤型等に関する特許発明において,対象製品が政令処分申請時における周知・慣用技術に基づき,一部において異なる成分を付加,転換等しているような場合で,特許発明の内容に照らして,両者の間で,その技術的特徴及び作用効果の同一性があると認められるとき,③政令処分で特定された「分量」ないし「用法,用量」に関し,数量的に意味のない程度の差異しかない場合,④政令処分で特定された「分量」は異なるけれども,「用法,用量」も併せてみれば,同一であると認められる場合は,これらの差異は上記にいう僅かな差異又は全体的にみて形式的な差異に当たり,対象製品は,医薬品として政令処分の対象となった物と実質同一なものに含まれるというべきである(なお,上記①,③及び④は,両者の間で,特許発明の技術的特徴及び作用効果の同一性が事実上推認される類型である。)。
これに対し,前記の限定した場合を除く医薬品に関する「用法,用量,効能及び効果」における差異がある場合は,この限りでない。なぜなら,例えば,スプレー剤と注射剤のように,剤型が異なるために「用法,用量」に数量的差異以外の差異が生じる場合は,その具体的な差異の内容に応じて多角的な観点からの考察が必要であり,また,対象とする疾病が異なるために「効能,効果」が異なる場合は,疾病の類似性など医学的な観点からの考察が重要であると解されるからである。
2 本件についての検討
(1)一審被告各製品が本件各処分の対象となった物と同一であるか否かについて
医薬品の成分を対象とする物の特許発明の場合,法68条の2によって存続期間が延長された特許権は,「成分,分量,用法,用量,効能及び効果」によって特定された「物」についての「当該特許発明の実施」の範囲で効力が及ぶものである。
これを本件についてみるに,本件処分1,3及び5の対象となった医薬品はエルプラット50,本件処分2,4及び6の対象となった医薬品はエルプラット100,本件処分7の対象となった医薬品はエルプラット200であるところ,・・・証拠及び弁論の全趣旨によれば,エルプラット50,同100及び同200は,「成分」及び「分量」のうち,「分量」のみが異なるものであって,「成分」はいずれも「オキサリプラチン」と「注射用水」のみを含み,それ以外の成分を含まないものとされていることが認められる。
延長登録された本件特許権の効力は,本件各処分の「成分,分量,用法,用量,効能及び効果」によって特定された「物」についての「当該特許発明の実施」の範囲で及ぶところ,本件各処分の「成分」は,文言解釈上,いずれもオキサリプラチンと注射用水のみを含み,それ以外の成分を含まないものである。
これに対し,一審被告各製品の「成分」は,いずれもオキサリプラチンと注射用水以外に,添加物としてオキサリプラチンと等量の濃グリセリンを含むものであり,その使用目的は安定剤としてである。
そうすると,本件各処分の対象となった物と一審被告各製品とは,少なくとも,その「成分」において文言解釈上異なるものというほかなく,この点の差異が,僅かな差異又は全体的にみて形式的な差異であるとして,法68条の2の実質同一といえるのか否かを判断すべきことになる。
(2)一審被告各製品が本件各処分の対象となった物と実質同一なものに含まれるか否かについて
ア 一審被告各製品と本件各処分における「成分」における上記差異が,僅かな差異又は全体的にみて形式的な差異であり,実質同一の範囲内の差異か否かについては,本件発明の内容に基づき,その内容との関連で,本件各処分において定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して,当業者の技術常識を踏まえて,これを認定判断する必要がある。
イ 本件明細書の記載によれば,オキサリプラティヌムは,種々の型の癌の治療に使用し得る公知の細胞増殖抑制性抗新生物薬であり,本件発明は,そのオキサリプラティヌムの凍結乾燥物と同等な化学的純度及び治療活性を示すオキサリプラティヌム水溶液を得ることを目的とする発明である(前記1(2)ウの②の類型の特許発明に該当する。)。そして,本件明細書には,オキサリプラティヌム水溶液において,有効成分の濃度とpHを限定された範囲内に特定することと併せて,「酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まないオキサリプラティヌム水溶液」を用いることにより,本件発明の目的を達成できることが記載されており,「この製剤は他の成分を含まず,原則として,約2%を超える不純物を含んではならない」との記載も認められる。
これによれば,本件発明においては,オキサリプラティヌム水溶液において,有効成分の濃度とpHを限定された範囲内に特定することと併せて,何らの添加剤も含まないことも,その技術的特徴の一つであるものと認められる。
以上によれば,本件各処分と一審被告各製品とにおける「成分」に関する前記差異,すなわち,本件各処分の対象となった物がオキサリプラティヌムと注射用水のみからなる水溶液であるのに対し,一審被告各製品がこれにオキサリプラティヌムと等量の濃グリセリンを加えたものであるとの差異は,本件発明の上記の技術的特徴に照らし,僅かな差異であるとか,全体的にみて形式的な差異であるということはできず,したがって,一審被告各製品は,本件各処分の対象となった物と実質同一なものに含まれるということはできない。
ウ よって,一審被告各製品は,作用効果の同一性などその余の点について検討するまでもなく,本件各処分の対象となった「成分,分量,用法,用量,効能及び効果」によって特定された「物」についての本件発明の実施と実質同一なものとして,延長登録された本件特許権の効力範囲に属するということはできない。
(3)技術的範囲の属否について
一審被告各製品が本件発明の技術的範囲に属するかについても判断する。
本件発明の特許請求の範囲の記載の「オキサリプラティヌムの水溶液からなり」との構成要件Cは,オキサリプラティヌムと水のみからなる水溶液であるのか,オキサリプラティヌムと水からなる水溶液であれば足り,他の添加剤等の成分が含まれる場合も包含されるのかについて,特許請求の範囲の記載自体からは,いずれの解釈も可能である。そこで,構成要件Cについては,本件明細書の記載及び出願の経過を参酌して判断する。
前記(2)アのとおり,本件明細書には,オキサリプラティヌム水溶液において,有効成分の濃度とpHを限定された範囲内に特定することと併せて,「酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まないオキサリプラティヌム水溶液」を用いることにより,本件発明の目的を達成できることが記載されており,「この製剤は他の成分を含まず,原則として,約2%を超える不純物を含んではならない」との記載も認められる。
他方で,本件明細書には,「該水溶液が,酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤」を含有する場合に生じる不都合についての記載はなく,実施例においても,添加剤の有無についての具体的条件は示されておらず,これらの添加剤を入れた比較例についての記載もない。
しかしながら,出願経過において一審原告が提出した本件意見書には,本件発明の目的が,「オキサリプラティヌム水溶液を安定な製剤で得ること」及び「該製剤のpHが4.5~6であること」に加えて,「該水溶液が,酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まない」点にあること,さらに,水溶液のpHが該溶液に固有のものであって,オキサリプラティヌムの水溶液の濃度にのみ依存すること,オキサリプラティヌムの性質上,本件発明の構成においてのみ,「安定な水溶液」を得られることがわざわざ明記されており,これらの記載を受けて,審査官が引用する引用文献1ないし3では,そのような「安定な水溶液」は得られないこと,すなわち,緩衝剤を含む凍結乾燥物やクエン酸を含む水溶液では,「オキサリプラティヌムの安定な水溶液」を得ることは(非常に)困難である旨が具体的に説明されている。
本件明細書の前記記載やこれらの出願経過を総合的にみれば,本件発明の課題は,公知の有効成分である「オキサリプラティヌム」について,承認された基準に従って許容可能な期間医薬的に安定であり,凍結乾燥物から得られたものと同等の化学的純度及び治療活性を示す,そのまま使用できるオキサリプラティヌム注射液を得ることであり,その解決手段として,オキサリプラティヌムを1~5mg/mlの範囲の濃度と4.5~6の範囲のpHで水に溶解したことを示すものであるが,更に加えて,「該水溶液が,酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まない」ことをも同等の解決手段として示したものである。
以上によれば,本件発明の特許請求の範囲の記載の「オキサリプラティヌムの水溶液からなり」(構成要件C)との文言は,本件発明がオキサリプラティヌムと水のみからなる水溶液であって,他の添加剤等の成分を含まないことを意味するものと解さざるを得ない。
これに対し,一審被告各製品は,オキサリプラチンと注射用水のほか,有効成分以外の成分として,オキサリプラチンと等量の濃グリセリンを含有するものであるから,一審被告各製品は,その余の構成について検討するまでもなく,本件発明の技術的範囲に属さないものといわざるを得ない。
3 結論
以上のとおりであるから,一審被告各製品に対し,延長登録された本件特許権の効力は及ばない。よって,一審原告の請求をいずれも棄却した原判決は相当であり,一審原告の本件控訴は理由がない。
2019年4月26日
エスエス国際特許事務所
エスエス国際特許事務所





